| �@�P�D���e |
�@�C���m-�o�b�q���R���R�̔����̂����ِ��Ƃo�b�q�@�̂��D�ꂽ���x�����V�����R�����o�@�Ƃ��āA�P�X�X�Q�N�ɂr��������ɂ���ď��߂ĕ���܂����B
�@�������Ȃ���A�R���ő����@�̏ꍇ�A�����}�[�J�[��|�{�זE���͂��߂Ƃ�����ʂ������݂��Ȃ��R���̌��o�ɂ͌��o�Z�x���Ⴂ���ߎg�p����B�܂��T���h�C�b�`�@�idouble
determinant)�ł́A�r�I�`�����Q���R�́A�X�g���v�g�A�r�W��������ٓI�Ɍ������邽�߁ADNA�̗ʂ������ƍR�����܂܂Ȃ��ꍇ�ł�DNA����������A�o���h�Ƃ��Č��o����A��ʐ��ɖ�肪����܂����B
�P�A�e�B�X�ł́A�ő��̍ގ��A�u���b�L���O�܁A�R�̂Ɍ���������j�_�i�^�O�j�̉��ǂ��s�����Ƃɂ�肱���̖������P���A�L�b�g�Ƃ��Ĕ̔����Ă���܂��B
|
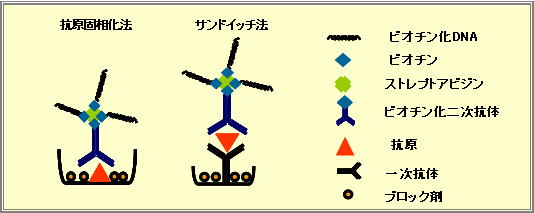
| �@�Q�D�L�b�g�̍\�� |
���r�I�`�������v���e�C��A/G�n�t
���X�g���v�g�A�r�W���n�t
���r�I�`�����I���S�k�N���I�`�h�^�O�iimTag�j
��PCR�p�v���C�}�[
�@�E�Z���X�iS)
�@�E�A���`�Z���X�iAS)
���g�b�v�C�[���h�iPCR�����`���[�u:Nunc�А��j
���u���b�L���O�n�t
���ő����n�t
�K�v�ȋ@��
���T�[�}���T�C�N���[
���K����PCR�Y���̌��o���u�i�d�C�j�����u�j |

�艿�F�ō�15,000�~�i16���̕��j
|
| �@�R�D������@�i�����j |
�@�@ |
| �@�S�D���{�� |
�C���mPCR�@�i�T���h�C�b�`�@�j��p�����t���I���Z�C���W���a�r�`�i���Ɛ���FF-BSA�j�̌��o���s�����B�{�@�ł�100pg/ml��F-BSA�����o���邱�Ƃ��ł��A�]���@�ł���ELISA(HRP)�@�Ɣ�ׂĖ�1000�{�����x�ł������B
�P�D�T���h�C�b�`�@
�y����@�z�i�T���j
1�D�ړI�̈ꎟ�R�́i�ő��p�j��Y�_�ɏՉt�Ŋ�߂��A�g�b�v�C�[���h�ɓY���B
�@�@2���Ԏ������u�B
2�DPBST100��l��3����
3�D100�ʂ��̃u���b�L���O�n�t100��l�����A2���Ԉȏ���u�B
�@�@O/N�̏ꍇ�͗①�ۑ��B
4�DPBST100��l��3����
5�D�ړI�R���ɑ���R�́i�R�́j��50�ʂ�����A�C���L���x�[�g�B
6�DPBST100�ʂ���3����
7�DimTag������߂��A50�ʂ�����A15���ԕ��u�B
8�DPBST100�ʂ���5����B
9�DPCR�̑���@�ɏ]���A�v���C�}�[S�A�v���C�}�[AS�������APCR���s���B
10�DPCR�Y���̓A�K���[�X�d�C�j���A���邢�͓K���ȋ@���p���đ���B
�@�@�R���W�i��p���邱�Ƃɂ���ʂ��邱�Ƃ��ł���B
���r�I�`�������v���e�C��A/G�n�t���g�p���邱�Ƃɂ��A�R�̂��r�I�`���������ɑ��肷�邱�Ƃ��ł��܂��B
���e����̔Z�x�ɂ��Ă͕ʓr���m�点���܂��B
|
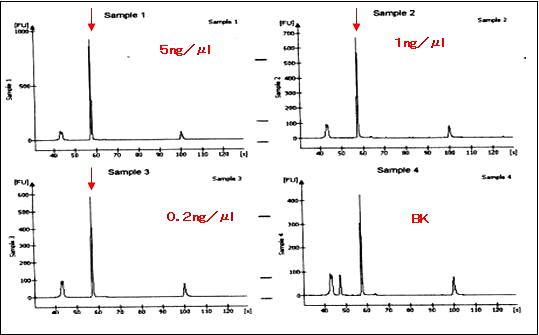
�y���ʁz
���́APCR���ꂽ���ꂽDNA�������A�R���iF-BSA�j�ʂɔ�Ⴕ�Ă��邱�Ƃ��킩��B(PCR:20�T�C�N���j
�sPCR���ʁt
�Q�D�R���ő����@
�y����@�z�i�T���j
1�D�ړI�̍R�����܂ގ������g�b�v�C�[���h�ɓY���B2���Ԏ������u�B
2�DPBST100��l��3����
3�D100�ʂ��̃u���b�L���O�n�t100��l�����A2���Ԉȏ���u�BO/N�̏ꍇ�①�ۑ��B
4�DPBST100��l��3����
5�D�ړI�R���ɑ���R�̂�50�ʂ�����A�C���L���x�[�g�B
6�DPBST100�ʂ���3����
7�DimTag����K���Ɋ�߂��A50�ʂ�����A15���ԕ��u�B
8�DPBST100�ʂ���5����B
9�DPCR�̑���@�ɏ]���A�v���C�}�[S�A�v���C�}�[AS�������APCR���s���B
10�DPCR�Y���̓A�K���[�X�d�C�j���A���邢�͓K���ȋ@���p���đ���B
�@�@�@�R���W�i��p���邱�Ƃɂ���ʂ��邱�Ƃ��ł���B
���r�I�`�������v���e�C��A/G�n�t���g�p���邱�Ƃɂ��A�R�̂��r�I�`���������ɑ��肷�邱�Ƃ��ł��܂��B
���e����̔Z�x�ɂ��Ă͕ʓr���m�点���܂��B |
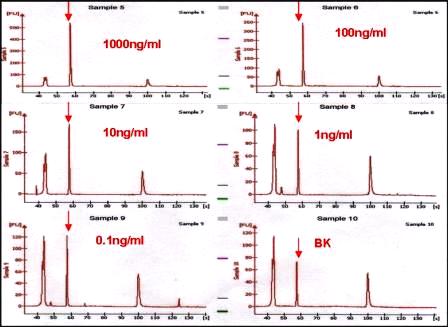
�y���ʁz
����PCR�����ꂽDNA�������A�T���h�C�b�`�@�Ƃقړ����̊��x�������A�R���iF-BSA�j�ʂɔ�Ⴕ�Ă��邱�Ƃ�������B

�g�b�v�����i�ē��������x�R�����o�E�C���mPCR(imTagPCR�j
|